中国的 Clinical Trial 热潮
中国的 Clinical Trial 热潮
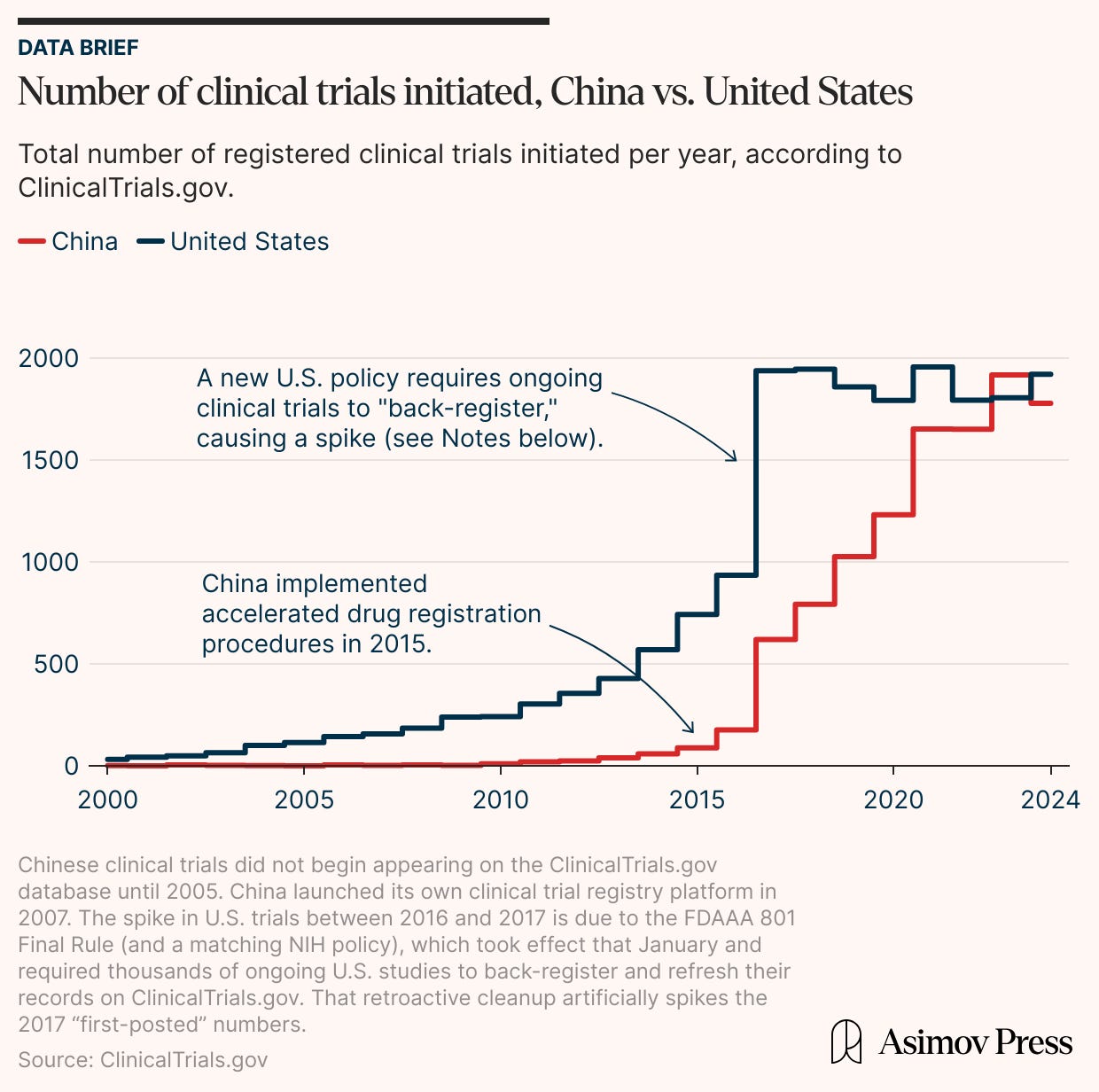
2017年,中国启动的 Clinical Trial 数量仅略高于 600 项。到 2023 年,这个数字接近 2,000 项。美国公司如何才能掀起类似的浪潮?
Hiya Jain 2025年4月24日
在1月份,中国公司 Deepseek 发布了一个名为 R1 的推理 AI 模型,该模型在某些 AI 基准测试中表现与 OpenAI 的 GPT-4o Turbo 模型相当,但开发资源更少,成本更低。Marc Andreessen 称其为“我见过的最惊人和令人印象深刻的突破之一”,即使 NVIDIA 的股票暴跌了 17%,这是美国公司有史以来最大单日跌幅。
尽管中国的 AI 竞争力可能让科技界措手不及,但制药行业已经经历了不少自己的“DeepSeek 时刻”。
目前,大约四分之一的 Clinical Trial和早期药物开发都在中国进行。根据 Stifel 的一份报告,大型制药公司从中国实验室获得了约三分之一的实验性分子(意味着他们购买了其他研究小组开发的分子,而不是自己内部发现的分子)。仅仅几年前,这个数字约为 10%。
生物技术专家 Alex Telford 写道:“十年前,一家寻求下一个突破性分子的大型[制药公司]会转向美国或欧洲的生物技术公司。 “今天,他们同样有可能从一家中国公司获得分子的许可。中国公司通常会在中国廉价地进行 I 期试验,然后将其转让给西方[制药公司],以进行昂贵的美国试验并将药物推向市场。”
这种转变的部分原因是政策。 中国监管机构通过了降低市场准入壁垒并简化审批的改革。 这些改革也可以为希望加快药物开发的美国监管机构提供经验。
注册 Asimov Press。 它将永远是免费的。
从 Clinical Trial 的注册数据中可以看到中国改革的影响。1 这些数据具有启发意义,因为注册人数可以衡量新疗法从概念到现实世界测试的行政负担。 专利申请和研发预算表明一个地区在发现方面的投入,但 Clinical Trial 活动表明项目如何应对官僚环境。 通过分析注册率如何响应政策、资金和疾病目标的变化,我们可以看到哪些方法最有效地加速了药物创新。 以下是数据显示的内容。
在 2010 年代初期,美国公司进行的 Clinical Trial 数量稳步增加,但随后稳定在每年约 1,900 项研究。 另一方面,中国的 Clinical Trial 数量在 2010 年代中期之前仍然相对较低。 然而,在政府简化审批政策后,Clinical Trial 的数量猛增。 中国公司在几年内赶上了美国的 Clinical Trial 量,同时保持了他们的平均注册轨迹(以略高的速度)。
中国 Clinical Trial 注册人数的跳跃并非源于少量大型的、后期阶段的试验(这会扭曲平均值)。 相反,源自中国的原始、新 药物的数量从 2010 年的几乎为零攀升 到 2023 年接近美国总数的数字。
他们是怎么做到的?
中国监管机构出台了几项措施来加快 Clinical Trial 的审批速度,包括优先审查和有条件批准新药。 符合优先审查资格的药物通常解决关键的、未满足的临床需求,从而使它们可以通过加速的评估时间表。
2017 年,中国国家药品监督管理局 (NMPA) 还启动了一项“默示许可”政策,如果监管机构在 60 天内未提出异议,则自动授权 Clinical Trial。 同年,中国加入了国际协调委员会 (ICH),并更新了其规则以接受海外 Clinical Trial 数据,从而减少了在中国重复进行整个研究的需要。 这意味着如果存在高质量的外国结果,公司不再需要在国内重复完整的试验。 安进公司的 XGEVA 是一种用于治疗骨癌的药物,于 2019 年获得批准,无需进一步的测试要求,基于一项全球 2 期研究,该研究不包括中国的 Clinical Trial 站点。 更容易的批准和在多个市场中具有商业可行性的结果也导致了国际投资,这进一步推动了该国的生物技术繁荣。
这些改革可能有助于解释为什么中国的 Clinical Trial 数量在 2017 年至 2023 年间增加了两倍,从每年约 600 项增加到近 2,000 项。 中国试验数量的增加也没有以减少招生人数为代价。
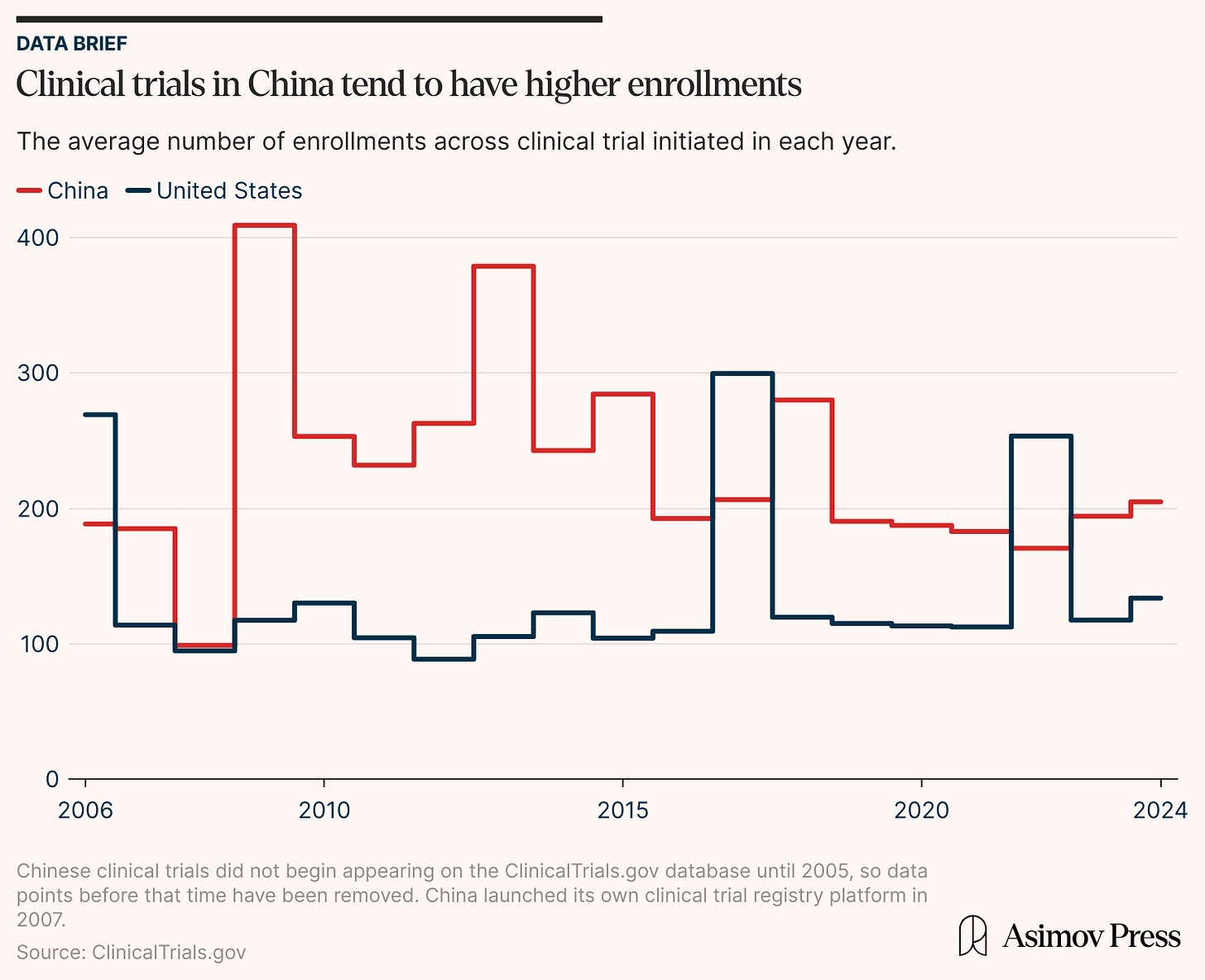
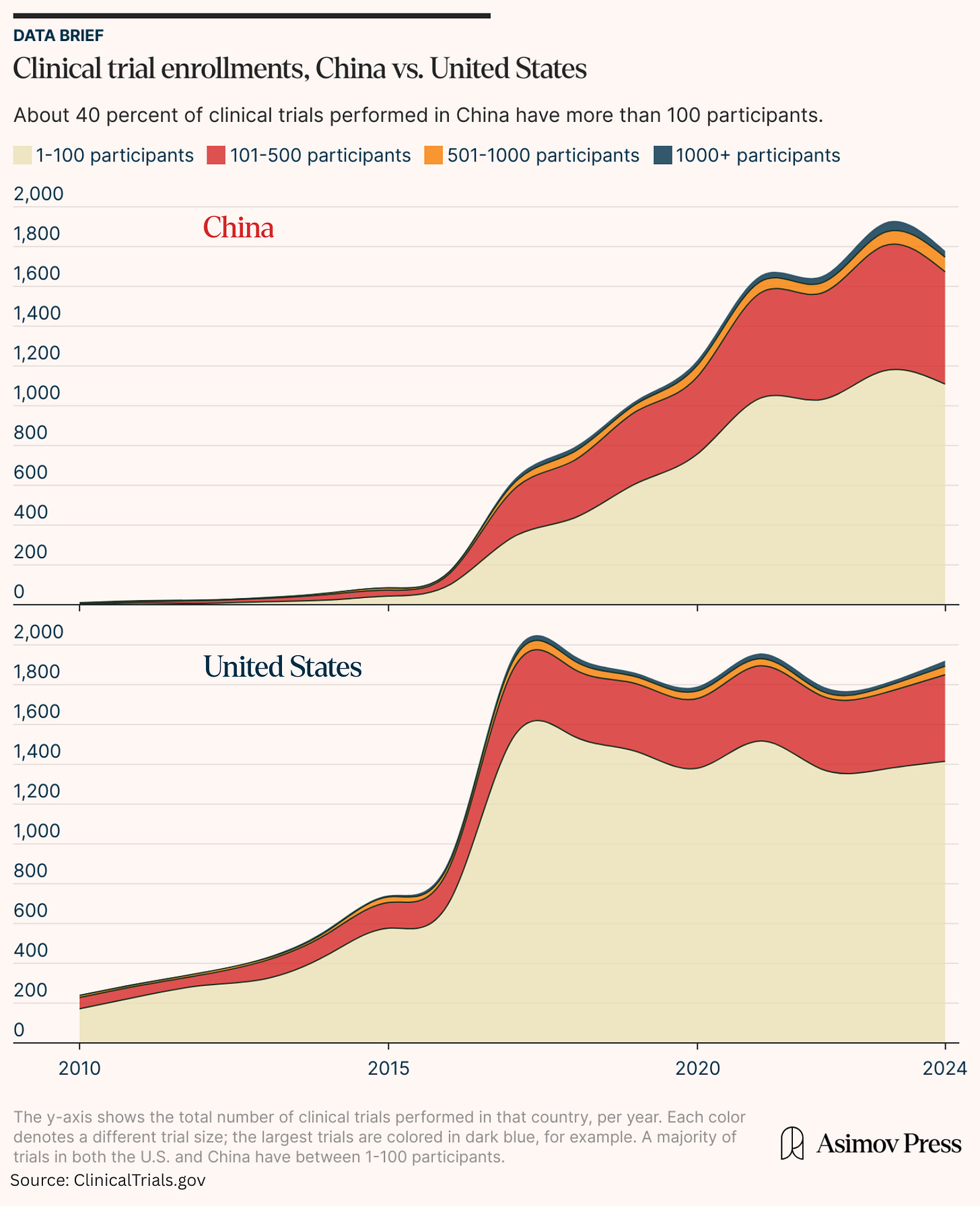
IQVIA 2023 年的一份报告指出,在疫情时期的峰值之后,全行业的试验复杂性有所下降,这有利于众多较小的研究。 这种趋势在美国数据中很明显,最近超过四分之三的试验现在招募少于 100 名参与者。 结果是许多美国试验规模较小且效力不足,有时是由于招募参与者方面的困难。 例如,肺癌的 LUNAR 试验 由于“缓慢的累积”而被迫将其注册人数减少一半。 相比之下,中国超过 40% 的 Clinical Trial 具有较高的注册水平。
最终,Clinical Trial 数据讲述了两种路径的故事:一种是开创了现代药物开发的美国系统,但现在显示出停滞的迹象,另一种是迅速上升的中国系统,该系统改革了其流程以最大限度地提高效率。
Telford 写道:“生物制药的进步最终是由人类数据收集的快速反馈循环驱动的。” “中国的监管改革使得药物进入人体更快、更便宜,而且目前中国生物制药生态系统的学习速度似乎比美国或欧洲的生物制药生态系统快得多。”
Clinical Trial 丰富倡议 的最新提案强化了这一更广泛的教训,表明“民主化” Clinical Trial 研究——通过扩大 Medicaid 覆盖范围以吸引更多参与者、通过简化文书工作消除不必要的行政负担以及允许公平的补偿等措施——可以提高 Clinical Trial 的速度和包容性。 然而,这些计划面临着一场艰苦的战斗,特别是考虑到持续的资金限制以及对 NIH 和 FDA 等机构的两极分化态度。
尽管如此,这些改革反映了鲜明的美国根源,针对的是国内障碍,例如分散的保险系统和机构官僚作风。 相比之下,中国的进步依赖于集中的协调、简化的审批途径以及自上而下的医院参与激励措施。2 尽管方法不同,但两种模型都表明,如何将监管结构与参与激励措施结合起来,有助于大规模释放试验能力和数量。
那些调整其框架以加快启动时间、承认可信的外国数据并在充分监督和有利于创新的政策之间取得平衡的国家,将有望抓住下一波药物发现的浪潮。日本、韩国 和印度 都在效仿中国的榜样。 美国应该也在其中。