模式生物并非一成不变:基因突变速率的差异
一项研究表明,某些脊椎动物的基因组突变速度比其他物种快 40 倍。
关于约 70% 的科学家表示他们曾尝试复制同行进行的实验但失败了。 动物研究可能属于最难重现的实验之列,因为为了减少研究中使用的动物数量,科学家通常 避免重复实验来确认积极的结果。1 然而,当动物研究被复制时,它们往往会产生不同的结果。
2006 年,阿尔伯塔大学的研究人员试图复制 1993 年的一项 小鼠研究。 但他们发现,当把他们的小鼠放入产生焦虑的迷宫时,它们 的压力水平与原始数据不同。 他们将结果的这种差异归因于实验室之间的细微差异,但是否还有其他原因呢?
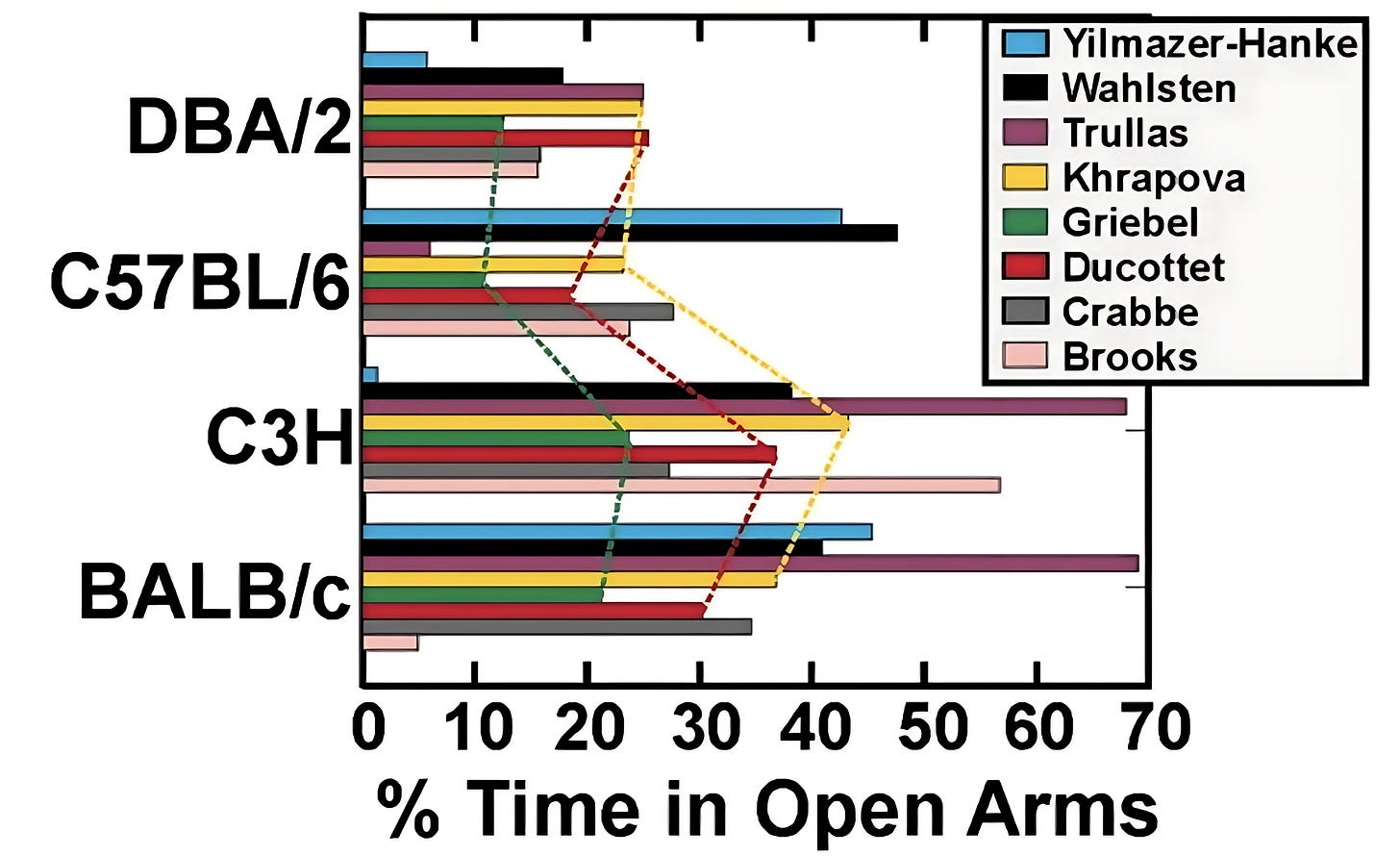 在 21 世纪初,八个独立的实验室对四个近交小鼠模型(DBA/2、C57BL/6、C3H 和 BALB/c)进行了相同的实验(称为“高架迷宫测试”)。 许多实验室(以其作者的名字命名)观察到截然不同的结果。 来源:Wahlsten D. et al.(2006).
在 21 世纪初,八个独立的实验室对四个近交小鼠模型(DBA/2、C57BL/6、C3H 和 BALB/c)进行了相同的实验(称为“高架迷宫测试”)。 许多实验室(以其作者的名字命名)观察到截然不同的结果。 来源:Wahlsten D. et al.(2006).
遗传学是部分原因。比较生活在野外的同一物种的两只动物的基因组,它们将存在许多遗传差异。 DNA 中的随机突变带来了这种遗传变异,并且不相关的个体之间的交配会将突变混合在种群中。
然而,比较近交模型动物品系的两个成员,它们将具有几乎相同的基因组。 这是经过设计的,并且会精心维护这些遗传相似性,以最大限度地减少遗传变异扭曲结果的程度。 即使如此,研究人员和动物模型供应商也无法完全阻止突变,这可能会扭曲实验结果。
例如,在 2023 年,哥本哈根大学的生态学家表明,在包括鸟类、鱼类、哺乳动物和爬行动物在内的 68 种脊椎(有骨干)动物中,每一代产生的突变数量 最多相差 40 倍 。 更容易发生基因突变的物种可能会更快地改变其特征。
研究中的大多数脊椎动物,包括实验鼠 Mus musculus ,每代每 1 亿个 DNA 碱基获得一个突变。 如果考虑到小鼠的基因组大小,这意味着与它们的父母相比,幼鼠平均获得 15 个新的突变。 小鼠基因组的变化速度比雪鸮(每个后代一个突变)快得多,但比达尔文的雷鸟(每个后代大约 47 个突变)慢得多。
然而,研究人员并没有在他们的分析中查看每一种模型动物。 该研究排除的常见模型脊椎动物包括非洲爪蟾 Xenopus laevis 和斑马鱼 Danio rerio ,它们都是胚胎学研究的支柱。 探索模型无脊椎(无骨干)动物(如线虫 Caenorhabditis elegans 和果蝇 Drosophila melanogaster )的种系突变率也可能值得。 但即便如此,科学家 研究的 脊椎动物之间的巨大差异应该促使其他人探索其他模型物种的基因组变化速度。
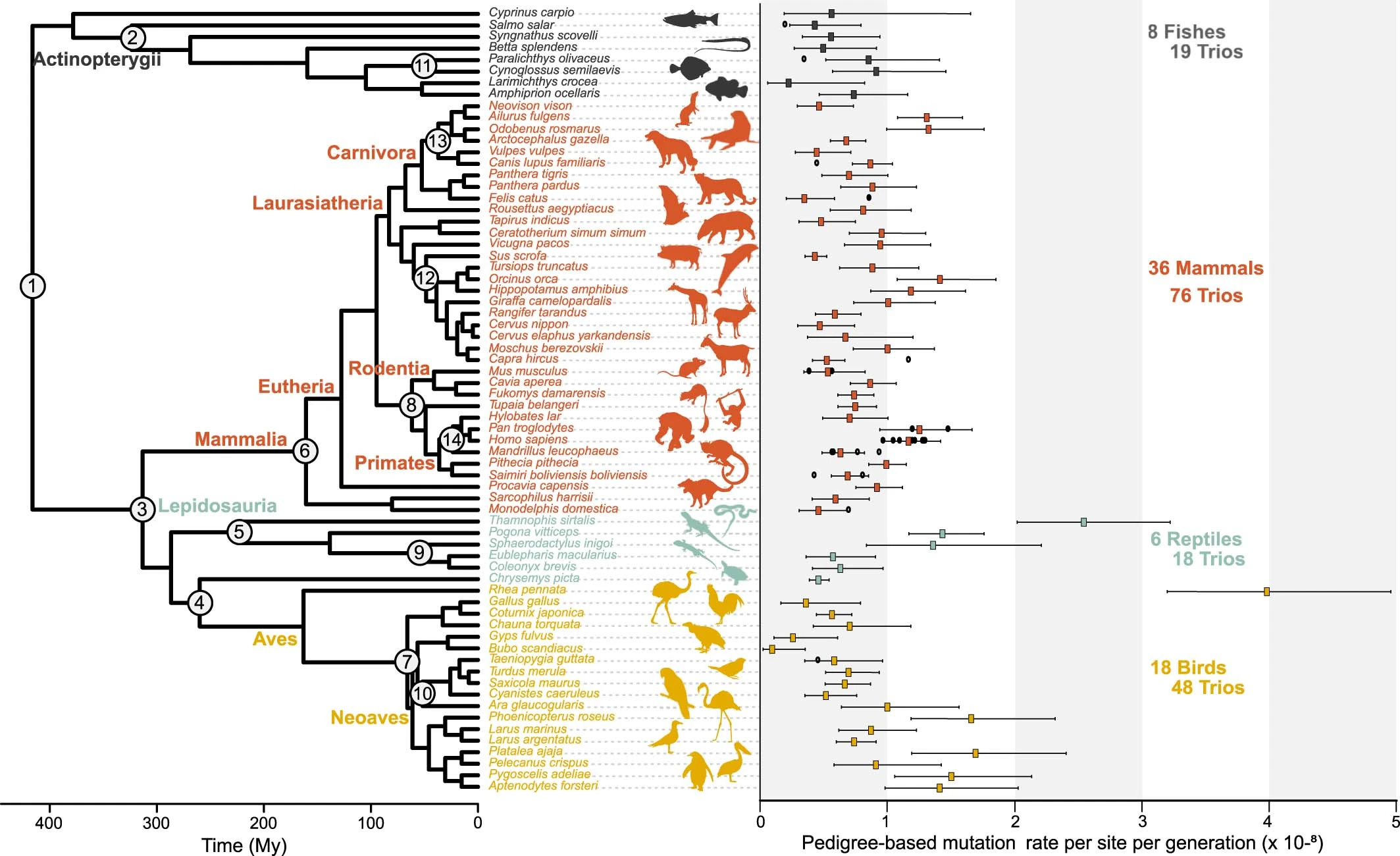 右侧图表中的每个彩色方块都显示了该生物体的观察到的突变率,并以线条绘制了 95% 的置信区间。 黑色方块是来自其他研究的突变率估计值。 许多爬行动物和鸟类的突变率远高于鱼类。 来源:Bergeron, L.A. et al.(2023).
右侧图表中的每个彩色方块都显示了该生物体的观察到的突变率,并以线条绘制了 95% 的置信区间。 黑色方块是来自其他研究的突变率估计值。 许多爬行动物和鸟类的突变率远高于鱼类。 来源:Bergeron, L.A. et al.(2023).
动物在一生中会在其细胞中积累突变,通常是因为在 DNA 复制过程中发生错误。 然而,对于这项研究,研究人员只关注种系中的 DNA 变化,或者产生性细胞的谱系。 种系突变通常不会影响亲本的特征,而是会遗传给它们的后代。
群体遗传学家认为,突变 有害的可能性大于有益,因为它们倾向于破坏复杂的基因通路,而不是改进它们。 野外的自然选择通常会消除有害的错误,这意味着较少的种系突变会保留在种群中。 然而,在实验室中繁殖的动物品系可能并非如此,实验室中的繁殖受到严格控制。 科学家们不是允许“最适合”的动物通过自然选择进行交配,而是人为地在相关的或特征明确的动物之间进行繁殖,即使(专家不知道)这些动物携带突变。 这可能会导致自然选择不赞成的有害突变在许多代中在种群中变得更加频繁。
与野生种群相比,动物设施也倾向于容纳较小的群体,这增加了问题。 小种群增加了有害突变持续存在的可能性。 在野生环境中,由于有足够的竞争和选择,有基因缺陷的动物最不可能繁殖。 但在一个狭小、受限的群体中,它们的机会增加了。
The Jackson Laboratory 繁殖和销售小鼠品系,它试图最大限度地减少种系突变在世代中的保留。 正如生物技术专家 Alex Telford 为 Asimov Press 撰文 时指出的,The Jackson Laboratory 在其缅因州的主校区和其他地方的备用设施中冷冻保存常见品系的小鼠胚胎。 技术人员每五年解冻一次这些小鼠胚胎,让它们发育,然后繁殖这些胚胎以“重置”它们的基因组。 他们说,这会将基因组变化率降低 20 到 50 倍,但并不能完全阻止它。 小鼠仍然在五年间隔内获得并传递突变。
既然我们知道每只小鼠幼崽都会获得 15 个新的突变,那么一个简单的粗略计算就能很快揭示五年期间的影响。 小鼠需要 三个月 才能从受精卵发育为性成熟的成年个体。 假设这些小鼠一旦达到成熟期就进行繁殖,那么五年内将发生 20 代。 通过将世代数乘以每代突变数,我们可以估计这些小鼠在五年期末将累积大约 300 个突变。2
 缅因州巴尔港的 The Jackson Laboratory。
缅因州巴尔港的 The Jackson Laboratory。
这 300 个突变中的大多数不会影响蛋白质编码基因,这些基因仅占小鼠基因组的 1.5%。 总共只有 4 或 5 个突变位于蛋白质编码区域。 其中一些突变可能会改变蛋白质序列,但这并不能保证蛋白质功能的改变:突变可能会影响可有可无的氨基酸,例如未参与活性位点的氨基酸,或者可能会将功能重要的氨基酸交换为具有相似特性的氨基酸,例如相似的极性或电荷。 有些突变可能根本不会改变氨基酸序列,因为 遗传密码中存在冗余,这允许多个 DNA 碱基三联体编码相同的氨基酸。
这些突变更有可能影响小鼠 DNA 的剩余 98.5%。 其中一些区域在通过 启动子、增强子和沉默子 等元件调节基因中发挥重要作用。 其他区域表达非编码 RNA,包括携带氨基酸的 转移 RNA(对蛋白质合成至关重要),或 microRNA(触发信使 RNA 的分解并抑制基因表达)。 因此,300 个种系突变的积累更有可能改变蛋白质编码基因的 调控,而不是它们的序列。
这些突变可能部分解释了可重复性危机。 正如 Telford 指出的,先前发现在小鼠品系肝脏中具有毒性的基因在引入同一品系但远缘相关的小鼠时,似乎可以 保护 肝脏功能,这可能是由于突变差异。 跟踪这些突变可能既耗时又昂贵,特别是如果考虑到基因组会因动物继承不同突变补充的小鼠设施而异。
尽管如此,科学家们可能需要考虑更频繁地对其小鼠品系进行测序,或者更频繁地使用转录组学或蛋白质组学分析来评估其基因调控模式的差异。 由此产生的数据可以让他们将具有基因改变特征的小鼠排除在育种计划之外。
认识到基因组变化对可重复性构成威胁,研究人员开始冷冻保存其他动物模型胚胎,以限制突变的负担。 明尼苏达大学的果蝇研究人员在 2021 年开发了一种 冷冻果蝇胚胎 的方法,该方法涉及在将胚胎快速浸入液氮之前,向其注射一种冷冻保护剂(一种防止冰膨胀和破坏细胞的化学物质)。 在匈牙利的圣伊斯特万大学,研究人员的目标是设计 冷冻斑马鱼胚胎 的方案,但他们必须首先找到一种无毒的冷冻保护剂。
生物学家努力从模型中获取尽可能多的信息; 在处理动物细胞时,他们使用高通量技术(如 单细胞 RNA 测序)来探索基因表达的差异,使用蛋白质组学来研究蛋白质水平如何变化,并使用表观遗传学分析来了解 DNA 的紧密包装如何调节基因。 现在,研究人员比以往任何时候都更有可能无意中记录下归因于种系错误积累的特征。
随着突变悄悄地重新塑造我们最受信任的模型物种的基因组,科学家们面临着一个明确的选择:正面应对这种变异性,或者冒着随着每一代传递而加剧可重复性危机的风险。